ジーラスタ[よくある医薬品Q&A]
用法及び用量(投与法・投与計画)
-
皮下投与部位は揉んだほうがよいですか?
特に揉む必要はありません。
2025年10月更新
MA-2022-199 -
本剤を投与した後に、Daily G-CSF製剤を追加投与してもよいですか。
NCCNガイドライン Hematopoietic Growth Factors (Version 1.2025 Therapeutic Use of MGFs (MGF-4))には、「ペグフィルグラスチムの予防的投与を受けている患者における発熱性好中球減少症に対するフィルグラスチムの治療的投与を検討した研究はない。しかしながら、ペグフィルグラスチムの薬物動態データは、好中球減少症時に高値を示しており、G-CSFの追加投与は有益ではない可能性があることを示唆しているものの、好中球減少症が長く遷延する患者では、G-CSFの追加投与を考慮する」と記載されています。
2025年10月更新
MA-2022-199 -
毎週投与の化学療法を行っている患者に投与してもよいですか。
NCCNガイドライン Hematopoietic Growth Factors (Version 1.2025 G-CSFs for Prophylaxis of Febrile Neutropenia and Maintenance of Scheduled Dose Delivery (MGF-B))には、毎週投与の化学療法でジーラスタを使用することを支持するデータは不十分のため、ジーラスタは使用すべきではないとしています。
添付文書には以下の記載があります。(引用文献1)
<7.用法及び用量に関連する注意>
7.1 がん化学療法剤の投与開始10日前から投与終了後24時間以内に本剤を投与した場合の安全性は確立していない。
【引用文献】
1)[ジーラスタ]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/gls.pdf ) 添付文書 [ジーラスタボディーポッド]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/glsobi.pdf ) 添付文書2025年10月更新
MA-2022-199 -
がん化学療法後に好中球が減少した患者に、治療的に投与してもよいですか。
ジーラスタの治療的投与は適応外です。また、治療的な投与での有効性・安全性を検討した臨床試験はありませんので、使用は推奨できません。
添付文書には以下の記載があります。(引用文献1)
<4.効能又は効果>
がん化学療法による発熱性好中球減少症の発症抑制
【引用文献】
1)[ジーラスタ]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/gls.pdf ) 添付文書 [ジーラスタボディーポッド]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/glsobi.pdf ) 添付文書2025年10月更新
MA-2022-199 -
化学療法と同日、もしくは化学療法後24時間以内に、本剤を投与してはいけないのはなぜですか。
ジーラスタ(G-CSF製剤)を抗がん剤と同時に投与すると、G-CSFによって分化・増殖過程に入った好中球系前駆細胞が抗がん剤によってより大きな障害を受け、逆に過度の好中球減少を起こす可能性があるためです。
G-CSF製剤を抗がん剤投与当日中、もしくは同時に投与した例では、G-CSF製剤を投与しない、あるいは同時に投与しなかった場合に比べ、好中球減少が強く生じていることが報告されています(参考文献1)。なお、米国臨床腫瘍学会(American Society of Clinical Oncology)による1994年の<CSF製剤の臨床使用に関するガイドライン>にも同様の記載があります(参考文献2)。
添付文書には以下の記載があります。(引用文献1)
<7.用法及び用量に関連する注意>
7.1 がん化学療法剤の投与開始10日前から投与終了後24時間以内に本剤を投与した場合の安全性は確立していない。
【参考文献】
1)Meropol NJ, et al. : J Natl Cancer Inst 84 (15), 1201-1203 (1992) [018-310]
2)J Clin Oncol 33 (28) 3199-3212 (2015) [026-507]
【引用文献】
1)[ジーラスタ]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/gls.pdf ) 添付文書 [ジーラスタボディーポッド]( https://medical.kyowakirin.co.jp/site/drugpdf/tenpupdf/glsobi.pdf ) 添付文書"2025年10月更新
MA-2022-199 -
G-CSF製剤の一次予防的投与を考慮すべき、がん化学療法時の発熱性好中球減少症リスク因子にどのようなものがありますか。
一般的に、発熱性好中球減少症(FN)の発現リスクは、化学療法レジメンおよび患者側の因子(年齢、合併症、PS、前治療歴など)が考慮されます。
各種ガイドラインにおいて、発熱性好中球減少症(FN)の発現に関するリスク因子が示されています。
<参考>JSCO:日本癌治療学会「G-CSF適正使用ガイドライン(2022年10月改訂 第2版)」(発熱性好中球減少症の発症リスクと相関する患者背景因子)
高齢、がん薬物療法や放射線療法の既往、Performance status不良や発熱性好中球減少症の既往など
ASCO:65歳以上の高齢者、進行癌、化学療法または放射線療法施行歴、治療前の好中球減少または腫瘍の骨髄浸潤、感染の存在、開放創の存在または最近の手術施行歴、Performance Status(PS)不良または栄養状態不良、腎機能障害、肝機能障害(特にビリルビン高値)、心血管疾患、複数の合併症、HIV感染
EORTC:高齢(65歳以上)、進行がん、レジメンの異なる先行化学療法におけるFNの既往歴
NCCN:
患者年齢65歳以上、前治療として化学療法や放射線療法を有する、好中球減少症や腫瘍の骨髄浸潤を有する、FN発症前の合併症がある(好中球減少症、感染症や開放創がある、直近に手術療法を受けた、Performance Statusが悪い、腎機能の低下、肝機能障害特に高ビリルビン血症、HIV感染症)
2025年10月更新
MA-2022-199 -
化学療法終了後翌日以降の投与であれば、いつ投与しても良いですか?72時間以降に投与してはいけませんか?
「翌日以降の投与」の明確な定義はありません。ただし、時間の経過とともに、抗がん剤の影響を受けて好中球が減少することから、治療的な投与となった場合は承認外となるため、注意が必要です。
【参考情報】
国内臨床試験では、化学療法剤投与翌日にジーラスタを投与していました。
【参考情報 日本癌治療学会 G-CSF適正使用ガイドライン 2022年10月改訂 第2版】
Q45:がん薬物療法でペグ化G-CSFを投与するとき、Day2とDay3~Day5のいずれが推奨されるか?
推奨:がん薬物療法でペグ化G-CSFを投与するとき、Day2とDay3~Day5のいずれも弱く推奨する。(推奨の強さ:2(弱い) エビデンスの強さ:C(弱))
解説:がん薬物療法でペグ化G-CSFを投与するとき、Day3~Day5の間に単回投与する群では、Day2に投与する群と比較し、FN発症率に有意差はなく、重篤な有害事象の発現率に有意差は見られなかった。現時点においては、投与スケジュールについて、いずれかを推奨するだけの根拠は乏しい。
(注:Day2はがん薬物療法投与終了翌日を指します)
【参考情報 海外のガイドラインの記載】
NCCN:Day2以降およびDay3~Day4までの投与が推奨されています。
ASCO:Day2からDay4までの投与が推奨されています。2025年10月更新
MA-2022-199 -
経口抗癌剤のレジメンにおいて、ジーラスタはいつ投与したらよいですか?
一般的に経口抗癌剤の投与レジメンは、2週間連続投与後1週間の休薬をするレジメンが多いです。
ジーラスタの投与は、抗がん剤の種類として注射剤、経口剤の剤形を問わず、抗がん剤投与終了24時間以降のため、経口抗がん剤を投与している間はジーラスタの投与は出来ません。
なお、経口の抗癌剤を2週間連続投与した後は、好中球減少症が生じることも多く、本剤の適応症である「がん化学療法による発熱性好中球減少症の発症抑制」から外れてしまいます。
また、経口抗がん剤の休薬期間は1週間であることが多く、ジーラスタは、がん化学療法剤の投与開始10日前から投与終了後24時間以内の投与が推奨されないため、適応外の使用となります。
以上より、経口の抗がん剤を使用したレジメンでは、一般的にジーラスタを使用することは出来ないと考えられます。2025年10月更新
MA-2022-199
特殊患者への投与
-
腎機能低下患者および透析患者への投与は?
海外において化学療法を受けていない複数の重症度の腎機能障害患者30名を対象に薬物動態を評価した第I相試験の報告1)では、薬物動態に対する腎機能障害の影響は認められなかったことから、腎機能障害患者において用量調節は不要と考えられるとしています。
また、30名中6名の透析患者についても透析による薬物動態への影響は認められていないので、透析患者に対しても用量調節は不要と考えられたとしています。
[参考文献]
1) Yang BB, et al. : J Clin Pharmacol 48(9), 1025-1023 (2008) [025-110]2025年10月更新
MA-2022-199
副作用・安全性
-
白血球が上がり過ぎたこと(オーバーシュート)による副作用は認められていますか?
国内臨床試験では、白血球増加に起因する副作用は報告されていません。
使用成績調査(安全性情報)最終報告(2021年4月)によると、「白血球数増加」は承認時まで45例(7.12%)、使用成績調査11例(0.72%)が報告されています。
白血球増加に起因して引き起こされる2次的な有害事象は、使用成績調査の最終報告において、認められていません。2025年10月更新
MA-2022-199
配合変化・安定性
-
箱に入れた状態で室温保存した場合、使用できますか。
貯法外で保管された製品の使用は避けてください。
加速試験の結果は次の通りです。(引用文献1)
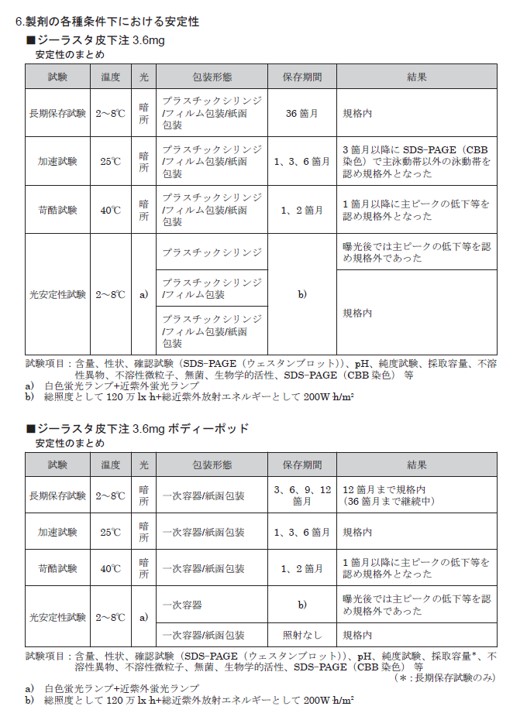
【引用文献】
1)[ジーラスタ]( https://medical.kyowakirin.co.jp/site/drugpdf/interv/gls_in.pdf ) インタビューフォーム【Ⅳ.製剤に関する項目 5.製剤の各種条件下における安定性 加速試験】2025年10月更新
MA-2022-199 -
ジーラスタ皮下注3.6㎎またはジーラスタ皮下注3.6mgボディーポッドを凍結してしまいました。製品の使用はできますか。
ジーラスタ皮下注3.6㎎及びジーラスタ皮下注3.6mgボディーポッドの貯法は「遮光下で2~8℃で保存」となっています。凍結した際のデータは取得しておらず、品質が保証できませんので、使用はお控えください。
2025年10月更新
MA-2022-199 -
ジーラスタ皮下注3.6mgボディーポッドを開封後使用しないことになった場合、次回使用できますか。
穿刺部と本体のブリスター包装を開けていない状態で貯法が守られていれば使用可能です。ブリスター包装を開けてしまうと、無菌性が保たれなくなります。
2025年10月更新
MA-2022-199
製剤学的事項
-
シリンジにはどのような注射針を使用すればよいですか?
ジーラスタ皮下注3.6㎎専用の注射針はありません。
JIS規格に適合し医療機器認証のある注射針であれば使用可能です。2025年10月更新
MA-2022-199 -
ジーラスタ皮下注3.6㎎を使用する前の注意点は?
ピロー包装からシリンジを取り出し、シリンジ先端部のフィルムとチップキャップをはずす前に、必ずプランジャーロッドを軽く「ワンプッシュ」してください。
これによってプランジャーロッドが動きやすくなり、エア抜きなどで余計な力が入り、注射液が多く飛び出してしまう懸念を減らせます。2025年10月更新
MA-2022-199






