このサイトは、日本国内の医療関係者(医師、薬剤師、看護師、技師・技士等)を対象に、弊社が販売する医療用医薬品を適正にご使用いただくための情報を提供しています。国外の医療関係者、一般の方に対する情報提供を目的としたものではありませんのでご了承ください。
このサイトのご利用に際しては、協和キリンメディカルサイトのご利用条件が適用されます。

会員登録をしていない方
医療関係者の方は、製品基本情報と一部コンテンツをご覧いただけます。
医療機関にお勤めの皆様を対象とした「協和キリンメディカルサイト」では、詳しい製品関連情報、医療用麻薬情報、各領域の学術情報、お役立ちコンテンツなどをご利用いただけます。ぜひこの機会にお申し込みください。
新規会員登録
会員の方
ノウリアスト®(一般名:イストラデフィリン;以下本剤)は、「レボドパ含有製剤で治療中のパーキンソン病におけるウェアリングオフ現象の改善」を効能又は効果として協和キリン株式会社で創製され、世界で初めて開発されたアデノシンA2A受容体拮抗薬です。
本剤は、1996年より臨床開発が開始され、世界に先駆けて本邦にて2013年3月に承認を取得しました。
また、2019年8月には、米国食品医薬品局(FDA)より新薬承認を取得しました。(米国販売名:NOURIANZ®)
監修:服部信孝 先生(順天堂大学医学部 神経学講座 教授)
非ドパミン系の受容体を標的とするアデノシン受容体拮抗薬の探索研究開始は,1980年代に遡ります。キサンチン骨格を修飾し,アデノシン受容体サブタイプ拮抗作用(A1,A2)を分離・増強することで,薬効を分離・増強するという発想から,協和キリン株式会社(以下,協和キリン)研究部門におけるアデノシン受容体拮抗薬創薬プロジェクト(以下,創薬プロジェクト)がスタートしました。
本創薬プロジェクトで副次的に合成されたアデノシンA2A受容体拮抗薬は,生体内におけるアデノシンA2A受容体の役割が不明であり,創薬としての方向性はわかっていませんでした。そこで,適応方向を探索するためin vivo行動薬理実験が実施され,アデノシンA2A受容体拮抗薬が運動機能に影響を及ぼすことを示唆する結果が得られました2)。また,1990年代に入り,アデノシンA2A受容体が大脳基底核(線条体,淡蒼球外節など)を中心に特異的に発現していること(表1)3),パーキンソン病(Parkinson's disease:PD)における運動症状の発現が大脳基底核回路の異常に起因すること4)5)が報告されました。
これらの科学的知見と行動薬理実験の結果に基づき,新規PD治療薬としてアデノシンA2A受容体拮抗薬を開発するための探索研究プロジェクトが1993年に開始されました。
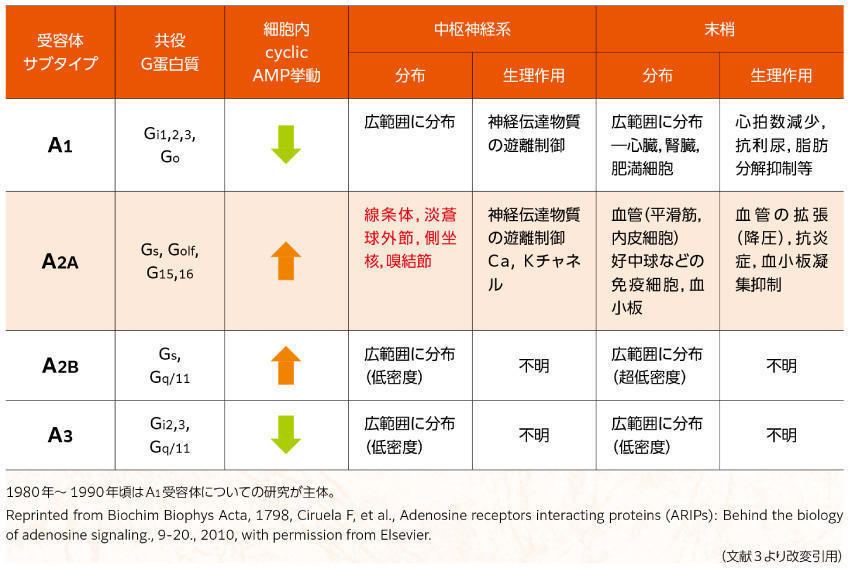
表1 アデノシン受容体サブタイプ(G蛋白質共役型受容体)の分布と機能
探索研究プロジェクトにおける薬理学的なアプローチにより,アデノシンA2A受容体拮抗薬はPDなどの病態において認められる運動抑制状態を改善する作用が期待できることが明らかになりました6)7)。また,ベルギーの研究グループにより,アデノシンA2A受容体が大脳基底核線条体の中型有棘神経細胞(medium spiny neuron:MSN)に特異的に発現していることが報告されていました8)。
これらのことを踏まえ,アデノシンA2A受容体はMSNの活動状態を調整する機構によって運動を制御している可能性が示唆され,電気生理学,神経化学,分子生物学的研究が進められました。その結果,アデノシンA2A受容体拮抗薬は線条体と淡蒼球において,A2A受容体へのアデノシンの結合を阻害し,ドパミン神経の変性・脱落によるMSNの過剰興奮を抑制すると考えられ,アンバランスになった神経のシグナル伝達を正常な状態に近づけ,運動症状を改善するとの作用仮説が構築されました9)10)。
その後のPET画像での研究において,PDでは尾状核および被殻において,ドパミントランスポーター(dopamine transporter:DAT)の結合が減少している一方,アデノシンA2A受容体の発現・増加が認められていることが報告されました(図1)11)。
また,作用仮説構築と同時進行で臨床開発候補化合物を求め,in vivo薬理作用増強に向けた化合物最適化の取り組みが実施され,ヒトアデノシンA2A受容体へ高い親和性とサブタイプ選択性を有するイストラデフィリンが創薬されました12)。
このような背景から最適化合物に選択されたイストラデフィリンの臨床開発は 1996年より開始され,国内・海外における臨床試験へと歩みを進めることとなったのです。
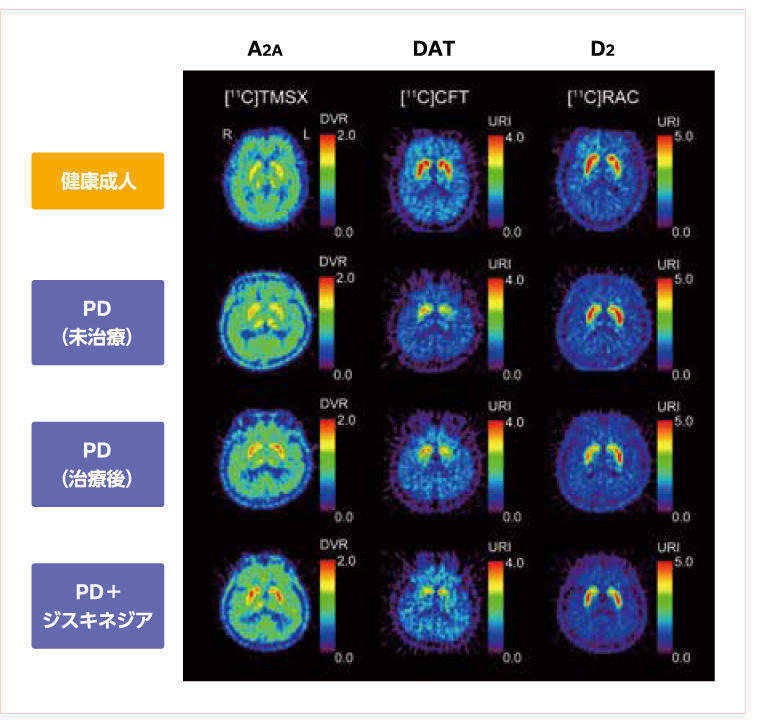
図1 パーキンソン病におけるアデノシンA2A受容体のPET画像
目的: 未治療PD患者,ジスキネジア発現PD患者の線条体における,アデノシンA2A受容体とドパミン作動性システムの関連,および,抗PD治療後のアデノシンA2A受容体の変化について検討した。
対象: 未治療PD患者 9例,ジスキネジア発現PD患者 7例,健康成人 6例の計22例。
方法: PETを使用し,線条体におけるアデノシンA2A受容体の結合能を測定・比較した。(文献11より引用)
https://creativecommons.org/licenses/by/4.0/
KKC-2020-00881-5
2023年11月作成